铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为( )
A. a+b) mol a+b) mol |
B.(a-b) mol | C. a-b) mol a-b) mol |
D.(a+b) mol |
下列方程式书写正确的是()
A.HCO3﹣在水溶液中的电离方程式:HCO3﹣+ H2O H3O++ CO32﹣ H3O++ CO32﹣ |
B.H2SO3的电离方程式:H2SO3 2H++ SO32﹣ 2H++ SO32﹣ |
C.CO32﹣的水解方程式:CO32﹣+2H2O H2CO3+2OH﹣ H2CO3+2OH﹣ |
| D.NaHCO3的电离方程式:NaHCO3 ═ Na++ H++CO32﹣ |
下列溶液一定是碱性的是()
| A.pH=6的某电解质的溶液 | B.c(OH-)>1×10-7mol/L |
| C.溶液中含有OH- | D.溶液中c(OH-)>c(H+) |
右图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升.制造此加热杯可选用的固体碎块是()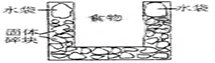
| A.硝酸铵 | B.生石灰 | C.氯化镁 | D.食盐 |
未来新能源的特点是资源丰富,使用时对环境无污染或很少污染,且有些可以再生,下列全部属于新能源的是一组是()
①天然气②煤③核能④石油⑤海洋能⑥地热能⑦风能⑧氢能.
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )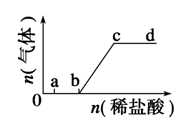
| A.a点对应的溶液中:Na+、OH-、SO42—、NO3— |
| B.b点对应的溶液中:Al3+、Fe3+、SCN-、Cl- |
| C.c点对应的溶液中:Na+、Ca2+、NO3—、Cl- |
| D.d点对应的溶液中:Fe2+、Na+、Cl-、NO3— |