甲、乙两个电解池均为 Pt 电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加 2.16g,乙池中电极上析出 0.24g 金属,则乙池中溶质可能是
| A.CuSO4 | B.MgSO4 | C.Al (NO3)3 | D.Na2SO4 |
现有浓度0.1 mol·L-1的五种电解质溶液①NA2CO3②NAHCO3③NAAlO2④CH3COONA⑤NAOH
已知:CO2+3H2O+2 ====2Al(OH)3↓+
====2Al(OH)3↓+
(1)这五种溶液的pH由小到大的顺序是_______________(填编号)。
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是_______________(填编号)。
(3)在上述五种溶液中分别加入AlCl3溶液,能产生无色无味气体的是_______(填编号)。
(4)将上述①②③④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:
_____________________________________________________________________。
(4分)关于小苏打溶液的表述正确的是_______________。
A.C(NA+)=C( )+C( )+C( )+C(H2CO3) )+C(H2CO3) |
B.C(NA+)+C(H+)=C( )+C( )+C( )+C(OH-) )+C(OH-) |
C. 的电离程度大于 的电离程度大于 的水解程度 的水解程度 |
D.存在的电离有:NAHCO3====NA++ , ,  H++ H++ ,H2O ,H2O H++OH- H++OH- |
(4分)常温下将稀NAOH溶液与稀CH3COOH溶液混合,不可能出现的结果是_______________________________。
| A.pH>7,且C(OH-)>C(NA+)>C(H+)>C(CH3COO-) |
| B.pH>7,且C(NA+)+C(H+)=C(OH-)+C(CH3COO-) |
| C.pH<7,且C(CH3COO-)>C(H+)>C(NA+)>C(OH-) |
| D.pH=7,且C(CH3COO-)>C(NA+)>C(H+)=C(OH-) |
将标准状况下的2.24 L CO2通入150 mL1 mol·L-1 NAOH溶液中,下列说法正确的是( )
A.C( )略大于C( )略大于C(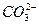 ) ) |
B.C( )等于C( )等于C(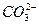 ) ) |
C.C(NA+)等于C(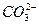 )与C( )与C( )之和 )之和 |
D.C( )略小于C( )略小于C(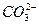 ) ) |
相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是()
| A.NaHSO4 CH3COONa NH4Cl NaNO3 |
| B.NaNO3 CH3COONa NaHSO4 NH4Cl |
| C.CH3COONa NaNO3 NH4Cl NaHSO4 |
| D.NaNO3 CH3COONa NH4Cl NaHSO4 |