已检测出pH=1的某未知溶液中含有Al3+和NO3-,被检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③Fe2+ ④K+⑤HCO3- ⑥Cl-,其中不必检验就能加以否定的离子是( )
| A.①②⑥ | B.②③④ | C.①③⑤ | D.④⑤⑥ |
某烷烃结构简式为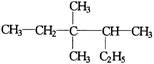 ,其命名正确的是
,其命名正确的是
| A.2-乙基-3,3-二甲基戊烷 | B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基己烷 | D.3,4,4-三甲基己烷 |
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O2与18O2互为同位素 |
| B.用石墨电极电解含有一定量H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
| C.20g H218O中含有12mol质子 |
D.SO3中的三个S-O键是等同的,向 2SO2(g) + O2(g)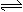 2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中 2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中 |
关于下列图示的说法中错误的是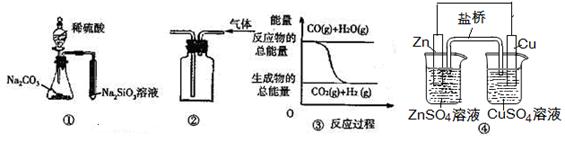
| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集H2气体 |
C.图③表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”为放热反应 CO2(g)+H2(g)”为放热反应 |
| D.图④中的装置可形成持续稳定的电流。将锌片浸入CuSO4溶液中发生的化学反应与图④中的原电池装置反应不相同 |
A、B、C、D、E 是同一短周期的五种元素, A和B的最高价氧化物对应的水化物呈碱性,且碱性前者强于后者,C和D的气态氢化物的水溶液呈酸性,且酸性前者强于后者,分别由C、D、E三种元素形成的单核离子中,E元素的离子半径最大,则它们的原子序数由大到小的顺序是
A.CDEBA B.ECDAB C.BAEDC D.BADCE
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,外电路电流由D到C;③A、C用导线相连后,同时浸入稀H 2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>C>D>B B.A>B>C>D
C.C>A>D>B D.C>B>D>A