某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液。观察到如下现象:
①CuS不溶于醋酸溶液;②CuS不溶于浓盐酸;③CuS不溶于浓硫酸;④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生。
根据上述现象,该同学得出了以下结论,其中正确的是( )
| A.CuS不溶于弱酸,能溶于强酸 |
| B.CuS不溶于非氧化性酸,能溶于氧化性酸 |
| C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使沉淀溶解平衡往溶解方向 移动 |
| D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体, |
使溶解沉淀平衡往溶解方向移动
下列叙述不正确的是()
| A.Na、Mg、Al元素最高价氧化物对应的水化物碱性逐渐减弱 |
| B.P、S、Cl 元素与氢气化合条件逐渐变易 |
| C.N、O、F元素最高价氧化物对应的水化物酸性逐渐增强 |
| D.Li、Na、K原子的半径逐渐增大 |
元素性质呈周期性变化的决定因素是()
| A.元素的原子半径大小呈周期性变化 | B.元素相对原子质量依次递增 |
| C.元素原子的核外电子排布呈周期性变化 | D.元素的主要化合价呈周期性变化 |
下列叙述正确的是()
| A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B.除短周期外,其它周期均为18种元素 |
| C.ⅠA族的所有元素均为金属元素 |
| D.副族元素没有非金属元素 |
最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似。下列说法正确的是()
| A.N60是一种新型化合物 | B.N60和14N都是氮的同位素 |
| C.N60和N2是同素异形体 | D.N60和N2是同分异构体 |
欧洲科学家将62Ni和208Pb经核聚变并释放出1个中子后,生成一种新的核素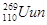 。该原子的原子核内中子数为()
。该原子的原子核内中子数为()
| A.110 | B.159 | C.161 | D.269 |