MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO2和MnCO3)样品转化为纯MnO2实验,其流程如下: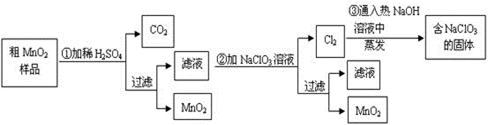
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式
+ ClO3-+ = MnO2↓+ + 。
(3)已知第③步蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。
有下列分子或离子:(1)BF3(2)H2O(3) NH4+
(4)SO2 (5)HCHO(6)PCl3(7)CO2
粒子构型为直线型的为:粒子的立体构型为V型的为:粒子的立体构型为平面三角形的为:粒子的立体构型为三角锥型的为::粒子的立体构型为正四面体的为。
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是()
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物,阴极放电反应最可能正确的是()
A.Q2++2e-→Q B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→TE.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是()
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是()
A.S区元素 B.稀有气体元素 C.p区元素D.准金属E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是()
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1) E.氦(1s2)
氯化溴(BrCl)的化学性质类似于卤素单质,试回答下列问题:
(1)氯化溴的电子式是,它是由键形成的分子。
(2)氯化溴和水反应生成了一种三原子分子,该分子的电子式为。
工业上可以用石油作原料生产乙醇,反应如下图所示: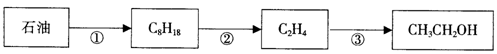
(1)从石油中分离出汽油、柴油、煤油的方法是:
(2)反应③的化学方程式。
(3)下列物质中不能与溴水发生反应的是
①乙烯②亚硫酸③NaOH溶液④AgNO3溶液⑤裂化汽油⑥甲烷⑦FeCl2溶液
| A.③④⑥ | B.①⑦ | C.⑥ | D.②⑤ |
(4)现有下列物质
互为同系物的有(填序号,下同),互为同分异构体的有,已知15g乙烷完全燃烧生成液态水放出akJ的热量,请写出乙烷完全燃烧的热化学方程式:
氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: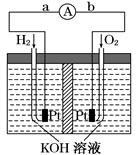
(1)氢氧燃料电池的能量转化主要形式是,在导线中电流流动方向为(用a、b表示),
(2)负极的电极反应式为,
(3)关于该电池的说法错误的是
| A.氢气在负极发生氧化反应 |
| B.供电时的总反应为:2H2+O2=2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.燃料电池的能量转化率可达100% |
(4)在下图所示的装置中,能够发生原电池反应的是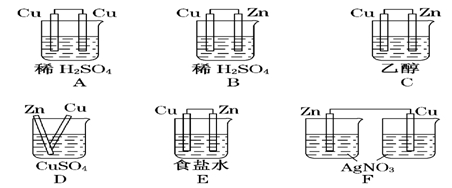
(5)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a附近滴加一滴石蕊试液,现象是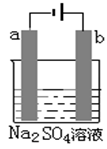
。