常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- |
| B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- |
| C.含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
| D.c(Al3+) =" 0.1" mol·L-1的溶液中:Na+、Cl-、AlO2-、SO42- |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,22.4 L H2O含有的分子数为 NA |
| B.28 g N2和N4组成的混合气体中含有的原子数为2 NA |
| C.1 mol·L-1A1Cl3溶液中含有的Cl-数目为3 NA |
| D.2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂 | B.N2被氧化 |
| C.AlN的摩尔质量为41 g | D.生成1 mol AlN转移3 mol电子 |
下列离子方程式书写正确的是
| A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+ |
| B.碳酸钙溶于稀盐酸:CO32- + 2H+ = H2O + CO2↑ |
| C.FeSO4溶液和NaOH溶液反应: Fe2+ + 2OH- = Fe(OH)2↓ |
| D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl- |
下列有关工业生产的叙述中错误的是
| A.电解氯化钠溶液制金属钠 |
| B.石灰石是炼铁和制玻璃的原料之一 |
| C.氯气通入石灰乳中制漂白粉 |
| D.硫酸工业的主要设备有沸腾炉、接触室、吸收塔 |
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是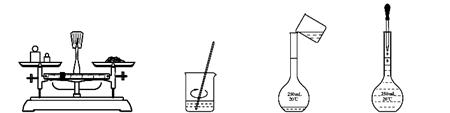
AB C D