已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确( )
| A.KCl为还原产物 | B.HCl全部发生氧化反应 |
| C.该反应表明氧化性KClO3比Cl2强 | D.1mol KClO3在反应中得到6mole- |
下列装置或操作能达到实验目的是( )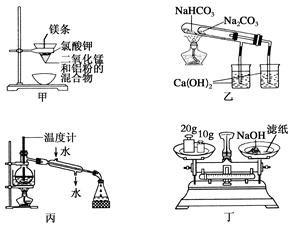
| A.用甲图装置可制得金属锰 |
| B.用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C.用丙图装置分离制取蒸馏水 |
| D.用丁图装置称量氢氧化钠固体 |
设NA代表阿伏加德罗常数的数值,下列说法正确的是()
| A.钠在氧气中燃烧生成1mol 物质时转移电子数为4 NA |
| B.标准状况 下22.4升的SO3中所含分子数为NA |
| C.16 g O2和O3的混合气体在常温下所含的氧原子数为NA |
| D.1mol·L-1 CuCl2溶液中含氯离子数为0.2 NA |
只用一种试剂可区别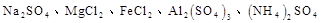 五种溶液, 这种试剂是()
五种溶液, 这种试剂是()
| A.Ba(OH)2 | B.H2SO4 | C.NaOH | D.AgNO3 |
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中()。
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
下列离子方程式正确的是 ()
| A.铝粉投入到NaOH溶液中:2Al + 2 OH-= 2AlO2- + H2↑ |
| B.钠与硫酸铜溶液反应:Cu2+ + 2Na = 2Na+ + Cu |
| C.AlCl3溶液中加入足量的氨水:Al3++ 3 OH-= Al(OH)3↓ |
| D.Ba(OH)2溶液与H2SO4溶液反应:Ba2++2OH-+2H++SO42-=BaSO4¯+2H2O |