已知:①C(s) +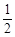 O2(g)
O2(g) CO(g);△H =" –" 110.5 kJ · mol – 1
②C(s) + O2(g) CO2(g);△H =" –" 393.51 kJ · mol – 1
则反应:C(s) + CO2(g) 2CO(g)的△H为 ( )
| A.– 283.01 kJ · mol – 1 | B.+ 172.51 kJ · mol – 1 |
| C.+ 283.01 kJ · mol – 1 | D.+ 504.00 kJ · mol – 1 |
在KClO3+6HCl KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是()
KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是()
| A.1:6 | B.1:5 | C.6:1 | D.5:1 |
向一盛有氯气的集气瓶中加入某液体,振荡后,能观察到无色溶液的现象,则加入的液体是()
| A.水 | B.碘化钾淀粉溶液 |
| C.氯化亚铁溶液 | D.氢氧化钠溶液 |
下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是()
A.CuO+2HNO3=Cu(NO3) 2+H2O 2+H2O |
| B.FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑ |
| C.C+4HNO3=CO2↑+2H2O+4NO2↑ |
| D.NH3+HNO3=NH4NO3 |
一定能在下列溶液中大量共存的离子组是()
| A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
| B.碱性溶液:Na+、Ca2+、SO42-、CO32- |
| C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- |
| D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
“荧光粉”所用的高纯度氯化钙中若混有镁离子,除去的方法是把氯化钙的水溶液加热到90—95℃,在不断搅拌的条件下加入适当的沉淀剂,使镁离子生成沉淀过滤除去。此沉淀剂最好是()
| A.烧碱 | B.纯碱 | C.小苏打 | D.石灰浆 |