如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是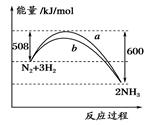
| A.加入催化剂,该化学反应的反应热改变 |
| B.b曲线是加入催化剂时的能量变化曲线 |
C.该反应的热化学方程式为:N2+3H2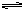 2NH3,ΔH=-92 kJ/mol 2NH3,ΔH=-92 kJ/mol |
| D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) ="=" 2H2O(1),△H=―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1),△H=+571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g),△H=―571.6 kJ/mol |
D.H2(g)+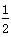 O2(g) ="=" H2O(1),△H=―285.8kJ/mol O2(g) ="=" H2O(1),△H=―285.8kJ/mol |
反应2A+3B=C+2D在2L的密闭容器中进行,半分钟后,C的物质的量增加了0.3 mol,则此反应的平均速率表达正确的是
A.v(C)=0.01 mol·L-1·s-1
B.v(B)=0.03 mol·L-1·s-1
C.v(A)=0.01 mol·L-1·s-1
D.v(D)=0.02 mol·L-1·s-1
已知下列两个热化学方程式
2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJ/mol
C3H8(g) +5O2(g) = 3CO2(g) + 4H2O(l);△H =-2220.0kJ/mol
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
可逆反应aX(g)+bY(g)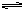 cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图象如图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图象如图。则下列说法中正确的是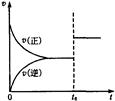
| A.若a+b=c,则t0时只能是增大了容器的压强 |
| B.若a+b=c,则t0时只能是加入了催化剂 |
| C.若a+b≠c,则t0时只能是增大了容器的压强 |
| D.若a+b≠c,则t0时只能是加入了催化剂 |