下列各组热化学方程式程中,△H的绝对值前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S (s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
| A.① | B.② | C.②③ | D.①②③ |
碘与氢气反应的热化学方程式为:
①I2(g)+H2(g) 2HI(g) ΔH=" -" 9.48 kJ·mol-1
2HI(g) ΔH=" -" 9.48 kJ·mol-1
②I2(s)+H2(g) 2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
| A.反应①的产物比反应②的产物稳定 |
B.I2(s) I2(g)ΔH=" +" 17.00 kJ·mol-1 I2(g)ΔH=" +" 17.00 kJ·mol-1 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol I2(g)中通入1 mol H2(g),反应后放热9.48 kJ |
反应 PCl5(g)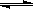 PCl 3(g)+Cl2(g)①
PCl 3(g)+Cl2(g)①
2HI(g)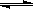 H2(g)+I2(g)②
H2(g)+I2(g)②
2NO2(g)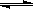 N2O4(g)③
N2O4(g)③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 |
| C.①增大,②不变,③减少 | D.①减少,②不变,③增大 |
可逆反应A(g)+B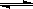 C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到达平衡时,下列叙述不正确的是
C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到达平衡时,下列叙述不正确的是
| A.若保持恒容,充入C气体后混合气体颜色加深,则说明B是有颜色的气体 |
| B.若升高温度,发现C的物质的量减少,则说明正反应为放热反应 |
| C.若压缩容器,平衡不移动,则说明B和D一定都是气体 |
| D.保持恒容,到达平衡后继续充入A会使B的转化率增大,A的转化率减少 |
某同学为了使反应2HCl + 2Ag 2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是:
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是: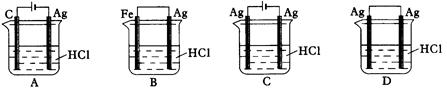
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是 
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)ΔH<0 CO(NH2)2(s)+H2O(g)ΔH<0 |
B.CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0 CO(g)+H2O(g)ΔH>0 |
C.CH3CH2OH(g) CH2==CH2(g)+H2O(g)ΔH>0 CH2==CH2(g)+H2O(g)ΔH>0 |
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH==CH2(g)+2H2O(g)ΔH<0 2C6H5CH==CH2(g)+2H2O(g)ΔH<0 |