【化学——选修化学与技术】现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下: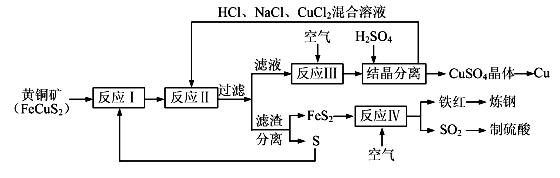
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________ 。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2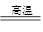 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
| A.反应中被还原的元素只有氧 | B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 | D.当有8mol铜生成时,转移电子数目为100NA |
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为________________________________________________ 。
常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断:NH4HCO3溶液的pH_______7(填“大于”、“小于”或“等于”);
(3)将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4D.NH4Cl
按pH由大到小的顺序排列是:__________________________(填序号)
(4) 求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=_________mol/L,c(OH−)-c(HA)=_________mol/L
现有25 ℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(填“增大”、“减小”或“不变”)。
________。(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:___________________;所得溶液的pH________7(填“<”、“>”或“=”),用离子方程式表示其原因_______________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH)=a mol/L,则c(SO)=____________。
(4)若向氨水中加入pH=1的硫酸溶液,且氨水与硫酸溶液的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___________________________________。
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= _____;
(3)该反应的平衡常数为 _____(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 ___。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol H2 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1 c2的关系(填“>”、“<”或“=”)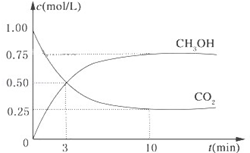
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9kJ/mol
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________。
(2)反应②中的能量变化如图所示,则ΔH2=_________________________。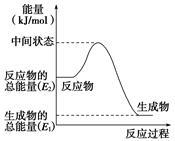
(3)H2(g)的燃烧热为____________________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。N-H键的键能是_________
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式:① 。
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② 。
(3)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______(填“>7”、“<7”、“=7”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/.
(4)纳米MgO可用于尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
3 |
3:1 |
实验②和④探究a 实验②和b 探究反应时间对产率的影响 |
| ② |
378 |
4 |
4:1 |
|
| ③ |
378 |
3 |
c |
|
| ④ |
398 |
4 |
4:1 |