在容积为2L的密闭容器中,有反应:mA (g) + nB (g) pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min), C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min), C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
| A.3:1:2:2 | B.1:3:2:2 | C.1:3:2:1 | D.1:1:1:1 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关说法正确的是 ( )
A.NF3是氧化剂,H2O是还原剂
B. B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,转移0.2 mol电子
D.NF3在潮湿空气中泄漏会产生红棕色气体
下列反应的离子方程式正确的是( )
| A.碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++H2O+CO2↑ |
| B.硫酸铝溶液中加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH |
| C.向足量的溴化亚铁溶液中通入少量氯气:2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl- |
| D.碳酸氢钠溶液与足量的氢氧化钡溶液混合: |
Ba2++2OH-+2HCO===BaCO3↓+CO+2H2O
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是( )
| A.所得沉淀为0.05 mol的BaSO4 | B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol | D.a的取值范围为0.672<a<0.896 |
将足量NH3通入HNO3和AgNO3的混合溶液中,生成沉淀的物质的量(n)和通入NH3的体积(V)关系(如图所示)正确的是( )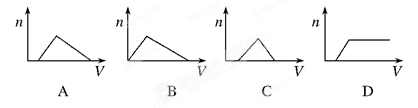
某溶液中存在较多的H+、SO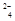 、NO
、NO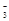 ,则溶液中还可能大量存在的离子组是()
,则溶液中还可能大量存在的离子组是()
| A.Mg2+、Ba2+、Br— | B.Al3+、CH3COO一、Cl— |
| C.Mg2+、Cl—、Fe2+ | D.Na+、NH4+、Cl— |