金属的活泼性顺序排列如下:
元素符号 K Ca( )Mg Al Zn Fe Sn Pb (H) Cu(Hg)Ag Pt Au
元素名称 钾 钙(钠)镁铝锌铁 锡 铅 氢 铜( )银 铂 金
(1)请在上图( )里填上适当的元素符号或元素名称
(2)已知置换反应:A + B → C + D 能够发生。
①若D为H2,B为稀硫酸,则A的选择应满足的条件是 ,
②若D为Cu,写出一个符合该条件的化学方程式 。
(3)下列事实不能说明Zn比Ag活泼的是( )
| A.Zn能与AgNO3溶液反应,置换出Ag |
| B.Zn能与稀硫酸反应,Ag则不能 |
| C.自然界没有以单质形式存在的Zn,而有以单质形式存在的Ag |
| D.Zn的熔点为420℃,Ag的熔点为962℃ |
(4)实验室现有下列药品:盐酸(5%)、硫酸(5%);大小相同的镁片、铝片、铁片;铁粉、铝粉。某同学为了比较金属与酸的反应,按下图所示的实验方案进行实验。
从实验开始到反应5分钟,所观察到的现象记录如下:
| 编号 |
① |
② |
③ |
| 现象 |
金属表面立即有大量无色气泡冒出,反应不到5分钟金属已消失 |
金属表面慢慢有少量无色气泡冒出。反应到5分钟时,铝片上还在冒气泡 |
铁粉中不断有无色气泡冒出。气泡的量比②中多,溶液逐渐显浅绿色,反应到5分钟时,铁粉还在冒气泡 |
该同学根据上述实验现象得出结论:金属与酸反应的剧烈程度按镁、铁、铝的顺序减弱。
你认为该同学的结论是否合理(填“合理”或“不合理)_______________。理由是
。
在实验室中可选用下图所示装置制取几种常见的气体。请回答有关问题:
(1)A装置可制取多种气体,请写出制取其中一种气体的化学方程式,并用简单的方法验证所得的气体。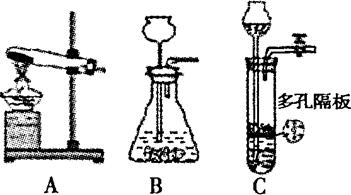
(2)实验室如用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔
隔板用来放块状固体),其优点是什么?
请分别写出除去下列物质中含有少量的杂质的化学方程式(括号内的物质为质)
(1) NaOH(Na2CO3):_______________________________。
(2) Cu(CuO):_____________________________________。
请回答有关金属活动性的问题:
(1)在Mg和Fe中,活动性较强的是____。
(2) Mn的活动性比Fe强,由此可知Mn与稀盐酸____填(“能”或“不能”)反应;
(3)用Fe和一种盐溶液验证Fe比Cu活泼,写出反应的化学方程式:
_______________________________________________________________
下图是A、B两种固体物质的溶解度曲线图,请回答下列问题:
(1)P点表示t1℃时,A的溶解度____B的溶解度(填“>”、“<”或“一”)。
(2)在其他条件不变的情况下,若把t1℃时A、B的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数关系为A____B(填“>”、“<”或“=”)。
(3)t2℃时,将30g B物质加入50g水中,所得溶液是____(填“饱和”或“不饱和”)溶液,所得溶液的质量为______g。
合理膳食可增强身体抵抗力,减小患流感的几率。小姚同学某日的午餐有红烧带鱼、米饭、鸡蛋汤,其中富含蛋白质的是____还需补充的营养素是________。