铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
下列叙述中,不能用平衡移动原理解释的是( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深 |
| D.工业合成氨反应中加压有利于提高氨气的产率 |
已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是()
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是()
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是()
| A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C.相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
| D.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
知:①2C(s)+O2(g) = 2CO(g)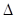 H= -221.0kJ/mmol
H= -221.0kJ/mmol
②2H2(g) + O2(g) =2H2O(g)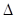 H= -483.6kJ/ol。
H= -483.6kJ/ol。
则制备水煤气的反应C(s) +H2O(g) = CO(g) + H2(g)的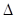 H为( )
H为( )
| A.+262.6kJ/mol | B.-131.3kJ/mol |
| C.-352.3kJ/mol | D.+131.3kJ/mol |
下列叙述中错误的是( )
| A.电解池是电能转化为化学能的装置 |
| B.原电池跟电解池连接后,电子从原电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |