下列说法中正确的是 ( )
| A.CO2 分子的键角是180°,类推出CS2分子的键角也是180° |
| B.不能用电解熔融状态AlCl3制取铝,类推出也不能用电解熔融状态MgCl2制取镁 |
| C.分子中只有共价键的化合物一定是共价化合物 |
| D.三氟化硼(BF3)和六氟化氙(XeF6)分子中的所有原子都满足最外层8电子结构 |
下列关于氧化物的说法,正确的是( )
| A.金属氧化物一定是碱性氧化物 | B.碱性氧化物一定是金属氧化物 |
| C.非金属氧化物一定是酸性氧化物 | D.碱性氧化物都能和水反应生成相应的碱 |
有5.1g镁、铝合金,投入500mL、2mol/LHCl溶液中,金属全部溶解后,再加4mol/LNaOH溶液,若要求达到沉淀最大值,则加入NaOH溶液应为()
| A.250mL | B.425mL | C.500mL | D.560mL |
向下列物质的浓溶液中缓慢地通入过量CO2气体,整个过程中无明显现象的是 ( )
| A.水玻璃 | B.澄清石灰水 | C.氯化钙 | D.饱和碳酸钠 |
现有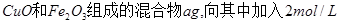 的硫酸溶液50ml,恰好完全反应,若将2
的硫酸溶液50ml,恰好完全反应,若将2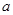 g该混合物在足量
g该混合物在足量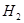 中加热,使其充分反应,冷却后剩余固体质量为()
中加热,使其充分反应,冷却后剩余固体质量为()
A.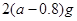 |
B.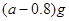 |
C. |
D.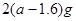 |
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为 ()
| A.6:1 | B.1:1 | C.2:1 | D.1:2 |