元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|
|
|
|
|
|
⑩ |
| 2 |
|
|
|
|
⑥ |
|
⑦ |
|
| 3 |
② |
③ |
④ |
|
|
|
⑧ |
|
| 4 |
⑤ |
|
|
|
|
|
⑨ |
|
请回答下列问题:
(1)十种元素中化学性质最不活泼的是 (填元素符号);
(2) 在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式);
(3) 元素①、②、⑤按原子半径由大到小的顺序依次为 (填元素符号),
原因 ;
(4) 元素⑥的氢化物的化学式为 ,其水溶液呈_____性(填“酸”、“碱”或“中”);
(5) 灼烧元素②与元素⑧形成的化合物,火焰呈 色;
(6)十种元素中 (填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为 。
已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,A的相对分子量小于30,在下图变化中,中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,(反应条件未写出)。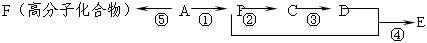
写出下列各步变化的化学方程式,并注明反应条件。
反应①;
反应②;
反应④;
反应⑤;
比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷,该反应的原子利用率为,决定氯乙烷能用于冷冻麻醉应急处理的具体性质是
已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有和两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式为
(3)乳酸与Na2CO3溶液反应的化学方程式为
(4)当乳酸和浓硫酸共热时,能产生多种酯类化合物,任意写出两种该类产物的结构简式、
陈先生有一套珍贵的铜制餐具,使用一段时间后餐具会变黑,陈先生会把餐具加热后用无水酒精浸泡,之后餐具便会光洁如新。请写出以上过程的所有化学方程式
,
“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。据测定每0.1m3固体“可燃冰”要释放20m3的甲烷气体,“可燃冰”将成为人类的后续能源。“可燃冰”(用甲烷表示)燃烧的化学反应方程式为:,若把该反应在一定条件下改装成原电池,则在原电池的负极发生反应的物质是:。