A~G是几种烃的分子球棍模型(如图),据此回答下列问题: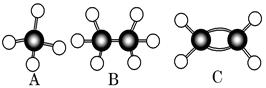
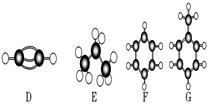
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)能够发生加成反应的烃有________种。
(3)一卤代物种类最多的是________(填字母)。
(4)写出实验室制D的化学方程式_____________________________________________
(5)写出F发生硝化反应的化学方程式_________________________________________
将与“实验操作”相对应的“实验现象”的字母代号填入“答案”栏中。
| 实验操作 |
答案 |
实验现象 |
| (1)将浓硫酸滴在小木条上 |
A.产生白烟 |
|
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 |
B.产生蓝色物质 |
|
| (3)在盛有KI淀粉溶液的试管中滴加氯水 |
C.溶液呈红色 |
|
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
D.变黑色 |
现有:①铁锅 ②鸡蛋 ③白酒 ④乙烯。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)。
(1)可以作为水果催熟剂的是;
(2)含有乙醇的是;
(3)在潮湿的空气中会生锈的是;
(4)富含蛋白质的是。
针对下面10种元素,完成以下各小题
(1)地壳中含量最多的元素是___________(填名称)。
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
C |
N |
O |
|||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
Ne |
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)Al的原子结构示意图为___________________。
(4)C与N相比,原子半径较小的是___________。
(5)最高价氧化物对应的水化物碱性最强的是___________(填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是___________。
(7)S和Cl相比,元素非金属性较强的是___________。
合理选择饮食、正确使用药物是保证身心健康的重要方面。请回答:
(1)富含蛋白质的食物,如肉、蛋、奶属于(填“酸性”或“碱性”)食物;
(2)青霉素是常用的抗生素,使用该药前一定要进行;
(3)某些微量元素、维生素摄入不足会引起疾病,例如铁元素摄入量不足可能会导致;
(4)食品添加剂可以改善食物的色香味。下图是某鲜橙汁包装上的说明,下列配料属于食品添加剂的是(填字母)。
A.纯净水B.天然食用香料
实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)用托盘天平称取十水合碳酸钠晶体(Na2CO3·10H2O)g。
(2)配制500mL0.1mol/L Na2CO3溶液时需用的主要仪器有托盘天平(带砝码、摄子)、烧杯、玻璃棒、、
等。
(3)若实验遇下列情况,则溶液的浓度可能会发生变化,在下列问题中选择填空:
A(偏高)
B(偏低)
C(不变)
①忘记将洗涤液转入容量瓶_______;②若该物质溶于水放热,溶解后没有冷却便转入容量瓶进行定容;③加水定容时超过刻度线_______。