硅单质及其化合物在材料领域中一直扮演着主要角色。下列叙述中,正确的是
| A.石英可用来制作工艺品 | B.硅单质可用来制造太阳能电池 |
| C.硅单质是制造玻璃的主要原料 | D.二氧化硅是制造光导纤维的材料 |
某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2②Cl2③CH4④HCl ⑤NH3⑥NO ⑦NO2⑧SO2,下列操作正确的是()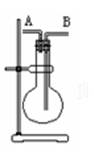
| A.烧瓶是干燥的,由B进气收集②④⑥⑦⑧ |
| B.烧瓶是干燥的,由A进气收集①③⑤ |
| C.在烧瓶中充满水,由A进气收集①③⑤⑦ |
| D.在烧瓶中充满水,由B进气收集⑥ |
在指定环境中,下列各组离子可以大量共存的是()
| A.在中性溶液中:Al3+、K+、S042-、 HCO3 |
| B.在由水电离的c(OH-)=10-14mol·L-1的溶液中:Fe2+、NH4+、NO3-、ClO- |
| C.在PH =11的溶液中:S032-、K+、Na+、C032- |
| D.在酸性溶液中: AlO2-、I一、NO3-、Na+ |
有M和R两种短周期主族元素,已知M+与R2-核外电子数之和为20,则下列说法中正确的是 ()
| A.R一定是第二周期元素 |
| B.M一定是第三周期元素 |
| C.M与R是同一周期元素 |
| D.R与M元素组成的化合物中可能存在非极性键 |
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()
| A.该反应在T1、T3温度时达到过化学平衡 |
| B.该反应在T2温度时达到化学平衡 |
| C.该反应的正反应是吸热反应 |
| D.升高温度,平衡会向正反应方向移动 |
近几年,液氯、液氨、硝基苯等物质的泄漏事故不断发生。下列说法正确的是
| A.液氯能使干燥的红色布条褪色 |
| B.液氨气化时吸收大量的热,可以用作致冷剂 |
| C.工业上用苯的硝化生产硝基苯,其原料无毒,符合绿色化学理念 |
| D.液氯、液氨、硝基苯泄漏都可以用NaOH溶液处理 |