某短周期元素原子的最外电子层只有2个电子,该元素可能是
| A.VIIA族元素 | B.IIA族元素 | C.第二周期元素 | D.IA族元素 |
25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法正确的是
| A.Ksp(CuS)约为l×10-20 |
| B.向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出 |
| C.向l00mL浓度均为10-5mol•L-1 Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 |
| D.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) |
一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:
3H2(g)+SO2(g) 2H2O(g)+H2S(g)
2H2O(g)+H2S(g)
| 容器编号 |
温度/℃ |
起始物质的量/mol |
平衡物质的量/mol |
||
| H2 |
SO2 |
H2 |
SO2 |
||
| 容器I |
300 |
0.3 |
0.1 |
/ |
0.02 |
| 容器II |
300 |
0.6 |
0.2 |
/ |
/ |
| 容器III |
240 |
0.3 |
0.1 |
/ |
0.01 |
下列说法正确的是
A.该反应正反应为吸热反应
B.容器II达到平衡时SO2的转化率比容器I小
C.容器III达到平衡的时间比容器I短
D.240℃时,该反应的平衡常数为1.08×104L• mol-1
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论不正确的是
| A.向浸取液中滴入AgNO3溶液有白色沉淀产生,说明雾霾中一定含有Cl- |
| B.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42- |
| C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3- |
| D.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+ |
从植物中分离出的活性化合物zeylastral的结构简式如图所示。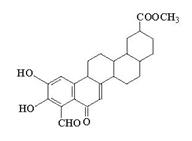
下列说法不正确的是
| A.分子中含有6个手性碳原子 |
| B.能与FeCl3溶液、银氨溶液发生反应 |
| C.1mol zeylastral最多与5molH2发生反应 |
| D.1mol zeylastral最多可与lmolBr2发生反应 |
下列有关说法正确的是
| A.铅蓄电池放电时,正极和负极的电极质量均增大 |
| B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0 |
| C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
| D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |