测定铜合金中铜的含量,可以用稀硝酸来溶解样品,也可以用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl===CuCl2+2H2O。假设样品中其他成分不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式并标出电子转移的方向和数目________________________________________________________________________。
(2)在铜与双氧水、盐酸的反应中氧化剂是________,若有2 mol的H2O2参加反应,则电子转移的物质的量是______________。
(3)用双氧水和稀盐酸溶解样品与用稀硝酸溶解样品相比较,哪种更好?为什么?
________________________________________________________________________。
现有①CaF2②金刚石③冰④干冰⑤Na2SO4⑥碘片⑦二氧化硅七种物质,按下列要求回答(填序号):
(1)晶体中既含离子键又含共价键的是_;(2)晶体熔化时需要破坏共价键的是_____;(3)熔点最低的是_____;(4)晶体中只存在一种微粒间作用力是____________;
下列各组物质:
①O2和O3 ②H2和D2③12C和14 C ④石墨和足球烯(C60)
⑦ CH3CH2OH(乙醇)和 CH3-O-CH3(二甲醚)
(1)互为同素异形体的是_____________;(2)互为同位素的是_______________。
(3)互为同分异构体的是_____________;(4)同一种物质的是_______________。
根据元素周期律和周期表回答下列问题:
⑴短周期中,金属性最强的元素是 ,非金属性最强的元素是 ;非金属元素共 种(稀有气体除外)(用化学用语回答,下同)。
⑵第3周期中,原子半径最小的元素(稀有气体元素除外)是 ,简单的离子半径最小的是 ,非金属性最强的元素是 ;
(3)周期表中位于第8纵列的铁元素属于第周期第族。周期表中最活泼的非金属元素位于第纵行。
2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。
现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
请按要求填空:
(1)写出下列反应的反应类型:①:_________,⑥:__________,⑧:_____________
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是,物质E的结构简式是_______________。
(4)反应⑩的化学方程式是___________________________________________。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知: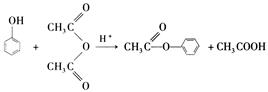
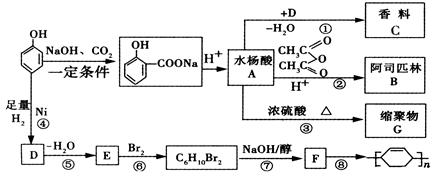
(1)写出C的结构简式。
(2)写出反应②的化学方程式。
(3)写出G的结构简式。
(4)写出反应⑧的化学方程式。
(5)写出反应类型:④,⑦。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是。
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液