在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中加入溴水,溴单质被还原,由此可推断该溶液中
| A.一定含有I-,不能确定是否有Cl— | B.一定含有NO3- |
| C.不含有Fe3+,一定含有Cl— | D.一定含有I一、NO3-和Cl |
a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为()
①(a+b)×63g②(a+b)×189g③(a+b)mol④mol
| A.①④ | B.②④ |
C.②③ | D.①③ |
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是()
A. |
B. |
C.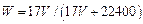 |
D.C="1000Vρ/(17V+22400)" |
第三届中国武陵山区(贵州·铜仁)民族文化节暨2010贵州梵净山文化旅游节在锦江河畔的铜仁民族风情园隆重开幕。在开幕式的晚会中现场观众手持被称为“魔棒”的荧光棒营造了很好的氛围,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:下列说法正确的是()
| A.CPPO属于芳香族化合物 |
| B.CPPO属于高分子化合物 |
| C.1mol CPPO与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4mol NaOH |
| D.1mol CPPO与氢气完全反应,需要氢气10mol |
下列离子方程式正确的是()
| A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2+ + 2OH-+ 2H+ + SO42-= BaSO4↓ + 2H2O |
| B.向100mL 0.1mol/L FeBr2溶液中通入0.01mol的Cl2: 2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 2Br2 + 6Cl- |
| C.AlCl3溶液与过量氨水混合:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向Mg(HCO3)2中加足量的Ca(OH)2溶液: |
Ca2++2OH-+2HCO3-+2Mg2+=CaCO3↓+MgCO3↓+2H2O
将充有mmL NO和nmL NO2的量筒倒立于水槽中,然后通入mmL O2,若m<n,则充分反应后,量筒内气体体积的毫升数为 ( )
A、3(m-n)B、m+C、 D、