常温时,下列溶液的pH或微粒的物质的量浓度关系不正确的是
A.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A一)=2c(H+)+c(HA)
B.某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a
D. pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR一)=c(Na+)
关于下列图示的说法中正确的是A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱()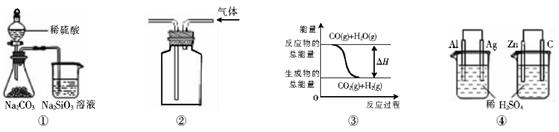
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
CaCO3溶于盐酸生成CO2,则下列说法中正确的是()
A.该反应的离子方程式为CO +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
| B.与同浓度盐酸反应,块状大理石的反应速率比粉末状的快 |
| C.CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使CaCO3的Ksp增大 |
D.CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH)+2c(CO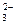 )+c(HCO )+c(HCO ) ) |
右图为室温下20 mL一定物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的图示,据图推出盐酸和NaOH溶液的物质的量浓度(mol·L-1)分别是()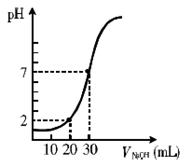
| A |
B |
C |
D |
|
| c(HCl)(mol·L-1) |
0.06 |
0.04 |
0.03 |
0.09 |
| c(NaOH)(mol·L-1) |
0.04 |
0.06 |
0.09 |
0.03 |
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质常用于制造太阳能电池,w的原子半径是同周期中最小的。下列推断中正确的是()
| A.Z的氢化物的热稳定性强于w的氢化物 |
| B.z的氧化物与水反应可制得相应的含氧酸 |
| C.X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
Li—SO2电池具有输出功率高和低温性能好等特点,其电解质是LiBr,溶剂是碳酸丙烯酯和乙睛,电池反应为2Li+2SO2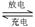 Li2S2O4。下列说法正确的是()
Li2S2O4。下列说法正确的是()
| A.该电池反应为可逆反应 |
| B.放电时,Li+向负极移动 |
| C.充电时,阴极反应式为Li++e-===Li |
| D.该电池的电解质溶液可以换成LiBr的水溶液 |