E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)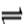 Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是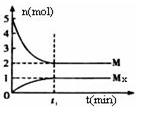
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,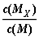 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
下列除杂方法正确的是
| A.SiO2中含Al2O3杂质,可以加入足量NaOH溶液然后过滤除去 |
| B.NH4Cl固体中混有少量的单质I2,可用加热方法将I2除去 |
| C.CO2中含有SO2杂质,可以通过盛有饱和Na2CO3溶液的洗气瓶除去 |
| D.NaHCO3溶液中含有Na2SiO3杂质,可以通入足量的CO2,然后过滤除去 |
以下有关原子结构及元素周期律的叙述正确的是
| A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
使溶液中的Al3+完全转化成Al(OH)3,应选择的最好试剂是
| A.NH3•H2O | B.HCl | C.H2SO4 | D.CO2 |
X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
| A.X与W形成化合物稳定性一定强于Z与W形成化合物 |
| B.Y、Z两元素的简单离子半径Y>Z |
| C.X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致 |
| D.Y元素最高价氧化物对应水化物的化学式为HYO4 |
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法错误的是
| A.制取玻璃和粗硅时生成的气体产物均为CO2 |
| B.生产铝、铜及高纯硅的过程中都涉及氧化还原反应 |
| C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 |
| D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |