氨的催化氧化4NH3(g)+5O2(g) 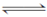 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
| A.以O2浓度变化表示的反应速率为0.064 mol·(L·s)-1 |
| B.反应达到平衡状态时NH3的转化率为20% |
C.升高温度能使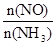 减小 减小 |
| D.将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol·L-1 |
有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍。则混合气体中CH4、C2H6、C3H8的体积比不可能是:
| A.2∶1∶2 | B.2∶3∶1 | C.1∶4∶1 | D.5∶3∶5 |
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验,从实验可以判断:
| A.该固体粉末中一定不含有BaCl2 |
| B.该固体粉末中一定含有KNO3 |
| C.它的组成可能是CaCO3、BaCl2、CuSO4 |
| D.它的组成一定是CaCO3、Na2SO4、KNO3 |
合成氨工业生产中所用的α—Fe催化剂的成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时混合物中铁的质量分数约为
| A.70.0% | B.77.8% | C.72.4% | D.75.0% |
离子方程式BaCO3+2H+="=" CO2↑+H2O+ Ba2+中的H+不能代表的物质是
①HCl②H2SO4③HNO3④NaHSO4⑤CH3COOH
| A.⑤ | B.④⑤ | C.②③⑤ | D.②④⑤ |
在标准状况下有:①6.72 L CH4;②3.01×1023个氯化氢分子;③13.6 g硫化氢;④0.2 mol氨气。四种气体中含有的氢原子数大小顺序为
| A.①>③>④>② | B.②>③>④>① |
| C.①>④>②>③ | D.②>③>①>④ |