甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
| A.a的浓度必小于乙酸的浓度 | B.a的浓度必大于乙酸的浓度 |
| C.b的浓度必小于乙酸的浓度 | D.b的浓度与乙酸的浓度无法比较 |
如图所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封,使细玻管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后用碘酒和硝酸银溶液分别检验蒸馏水。整个实验过程中,所观察到的现象是
| A.细玻管内液面上升 | B.细玻管内液面不变 |
| C.蒸馏水遇碘酒变蓝 | D.蒸馏水遇硝酸银溶液有白色沉淀生成 |
将淀粉碘化钾混合溶液装在羊皮纸制成的袋中,将此袋下半部浸泡在盛有蒸馏水的烧杯里,过一段时间后取烧杯中液体进行实验,下列现象能证明羊皮袋一定有破损的是
| A.加入碘水变蓝色 |
| B.加入NaI溶液不变蓝色 |
| C.加入AgNO3溶液产生黄色沉淀 |
| D.加入溴水变蓝色 |
下图以横坐标表示加入物质的质量,纵坐标表示溶液的pH变化。试分析哪个图像与哪项实验可能相对应?将其标号填在所列实验后面的括号内。(每个括号只能填一个标号)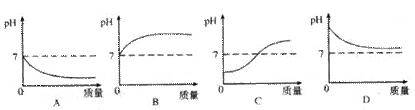
(1)向稀硫酸中逐滴加稀氢氧化钠溶液()
(2)向氢氧化钠溶液中逐滴加水稀释()
(3)向水中不断通二氧化碳()
(4)向水中加熟石灰()
碘(I)元素与氧元素可以形成多种化合物,其中一种为碘酸碘。在该化合物中,碘元素呈+3和+5两种价态,则这种化合物的化学式是
| A.I2O5 | B.I2O7 | C.I4O5 | D.I4O9 |
下列关于胶体的叙述不正确的是
| A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区分开来 |
| B.光线透过胶体时,胶体发生丁达尔现象 |
| C.用渗析的方法净化胶体时,使用半透膜只能让小分子和离子通过 |
| D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |