下列选项中,说明乙醇作为燃料的优点的是( )(1)燃料发生氧化反应(2)充分燃烧的产物不污染环境(3)乙醇是一种再生能源(4)燃烧时放出大量热
| A.(2) (3) (4) | B.(1) (2) (4) | C.(1) (3) (4) | D.(1) (2) (3) |
在一定温度下,硫酸铜晶体的培养皿中存在下列平衡: Cu2++SO42-+x H2O  CuSO4·xH2O,当向硫酸铜溶液(析有硫酸铜晶体)中加少量无水硫酸铜粉末后,下列说法中正确的是()
CuSO4·xH2O,当向硫酸铜溶液(析有硫酸铜晶体)中加少量无水硫酸铜粉末后,下列说法中正确的是()
| A.溶液中Cu2+浓度增大 | B.溶液中Cu2+数目不变 |
| C.硫酸铜晶体体积增大 | D.溶液的蓝色变浅 |
反应3H2(g) + N2(g)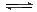 2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是()
2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是()
| A.随温度升高K增加 | B.随压强升高K增加 |
| C.随温度升高K减小 | D.随压强升高K减小 |
对于气体反应mA(g)+nB(g)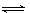 pC(g)+qD(g)△H的下列4个图象中,图象及对应解读均正确的是()
pC(g)+qD(g)△H的下列4个图象中,图象及对应解读均正确的是()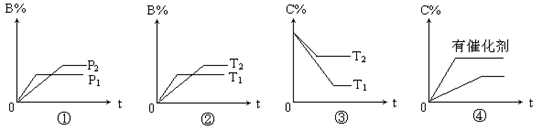
| A.图①表示反应从正反应开始,m+n>p+q |
| B.图②表示反应从逆反应开始,△H>0 |
| C.图③表示反应从逆反应开始,△H>0 |
| D.图④表示反应从正反应开始,有无催化剂参与反应的比较 |
反应FeO(s)+C(s)=Fe(s)+CO(g);△H>0,ΔS>0,下列说法正确的是()
A.低温下自发进行,高温下非自发进行 B 高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D任何温度下均为自发进行
在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加
bB(g)达平衡后,保持温度不变,将容器体积增加
一倍,当达到新的平衡时,B的浓度是原来的60%,则()
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.a > b |