下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅧA |
0 |
| 二 |
|
|
|
|
① |
|
② |
|
| 三 |
③ |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
| 四 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 ;
(2)化学性质最不活泼的元素是 ,其原子的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的是 ,呈两性的氢氧化物是 。
已知:
以乙炔为原料,通过下图所示步骤能合成有机中间体
(转化过程中的反应条件及部分产物已略去)。
其中,
、
、
、
分别代表一种有机物,
的化学式为
,分子中无甲基。
请回答下列问题:
(1)
生成
的化学反应类型是。
(2)写出生成
的化学反应方程式:。
(3)
在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比
小的有机产物的结构简式:。
(4)写出
生成
的化学反应方程式:。
(5)含有苯环,且与
互为同分异构体的酯有种,写出其中一种同分异构体的结构简式:。
短周期元素形成的常见非金属固体单质
与常见金属单质
,在加热条件下反应生成化合物
,
与水反应生成白色沉淀
和气体
,
既能溶于强酸,也能溶于强碱。
在足量空气中燃烧产生刺激性气体
,
在大气中能导致酸雨的形成。
被足量氢氧化钠溶液吸收得到无色溶液
。溶液
在空气中长期放置发生反应,生成物之一为
。
与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质
的元素位于周期表中第周期,第族。
(2)
与氢氧化钠溶液反应的化学方程式为:。
(3)
与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为,当生成2
二氧化氯时,转移电子
。
(4)溶液
在空气中长期放置生成
的化学反应方程式为:。
(5)
的溶液与稀硫酸反应产生的现象为。
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为
、
、
,
的最高化合价为+4)作原料,生产白色颜料二氧化钛的 主要步骤如下:
主要步骤如下:
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是。
(2)向滤液I中加入铁粉,发生反应的离子方程式为:、。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液
达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、、、(填化学式),减少废物排放。
(4)
可用于生产红色颜料(
),其方法是:将556
(摩尔质量为278
)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐 色胶体中加入3336
和112
铁粉,鼓入足量空气搅拌,反应完成后,有大量
附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料
。
色胶体中加入3336
和112
铁粉,鼓入足量空气搅拌,反应完成后,有大量
附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料
。
是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产
的合成路线:
已知以下信息:
①
可使溴的
溶液褪色;
②
中有五种不同化学环境的氢;
③
可与
溶液发生显色反应:
④
不能使溴的
褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)
的化学名称是;
(2)
的结构简式为;
(3)
与
反应生成E的化学方程式为;
(4)
有多种同分异构体,其中能发生银镜反应的是(写出结构简式);
(5)
的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是(写出结构简式)。
(Ⅰ)合金是生活中常用的材料,请回答下列问题:
(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为。不锈钢在空气中比较稳定,不易生锈,有强的抗腐蚀能力,其合金元素主要是;
(2)钢铁的腐蚀给社会造成的损失是巨大的,所以采取各种措施防止钢铁的腐蚀是十分必要的,请列举三种防止钢铁腐蚀的方法;
(3)青铜的主要合金元素为,黄铜的主要合金元素为:
(4)储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。如镧镍合金,它吸收氢气可结合成金属氢化物,其化学式可近似地表示为
(
中各元素化合价均可看作是零),它跟
可组成镍氢可充电电池: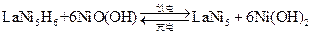
该电池放电时,负极反应是。市面上出售的标称容量为2000 mA h的1节镍氢电池至少应含有镧镍合金g(已知1法拉第电量为96500库仑或安培·秒)。
(Ⅱ)有机化合物与生活息息相关。请回答下列有关问题:
(1)棉花、蚕丝、小麦主要成分分别为、、,它们蕃都属于天然有机高分子化合物;
(2)味精是烹饪常用的调味品,其主要成分的化学名称为;
(3)解热镇痛药阿司匹林主要成分的结构简式为。