在检验SO42-的过程中,下列操作中正确的是
| A.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 |
| B.先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 |
| C.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 |
| D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示甲、乙丙物质问的转化一步就能实现,则甲可能是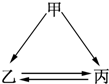
①Fe②HNO3③Al④Na2O2⑤C
| A.①③⑤ | B.①②③ | C.①②③⑤ | D.①②③④⑤ |
下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
| A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线 |
| B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |
某溶液中含有SO32-、Br-、SiO32-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的只有Na+
②有胶状沉淀物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
| A.①②③④⑤ | B.①②③④ | C.①③⑤ | D.②④⑤ |
元素周期表中ⅣA元素包括C、Si、Ce、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定。结合所学知识,判断下列反应中(反应条件略)正确的是
①Pb+2Cl2=PbCl4②Sn+2Cl2=SnCl4③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O
A.①②④⑤B.①②③④C.①②③D.②③⑤
常温下,下列各组粒子在指定溶液中能量共存的是
| A.在酸性KMnO4溶液中:Na+、C2H5OH、NH4+、Cl- |
| B.能溶解CaCO3的溶液中:Fe2+、Ca2÷、Cl-、NO3- |
| C.澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| D.能使淀粉-KIO3试纸显蓝色的溶液中:K+、H+、SO42-、I- |