用价层电子对互斥理论预测H2S和BF3的立体结构,两结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
使5.6LCO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),4.48L气体的质量是
| A.8.8 g | B.8.2 g | C.6.4 g | D.11g |
NA代表阿伏加德罗常数,下列说法正确的是
| A.1 L pH为3的FeCl3溶液中,由水电离产生的H+离子数目为0.1NA |
| B.乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子 |
| C.电解精炼铜(粗铜含锌、银等杂质)转移0.1NA个电子时,阳极溶解3.2g |
| D.在0.1mol的Na2O2中,有0.2NA个阴离子 |
为了使FeCl3溶液中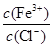 增大,可加入的物质是
增大,可加入的物质是
| A.适量的HCl气体 |
| B.适量的硫酸氢钠 |
| C.适量的NaOH固体 |
| D.适量的稀HNO3 |
下列离子方程式书写正确的是
| A.AlCl3溶液中加入足量的氨水:Al3++ 3OH-= Al(OH)3↓ |
| B.向H2O中投入少量Na2O2固体:2H2O+2Na2O2=2Na++ 2OH-+O2↑ |
| C.向碳酸氢钙(aq)中加入少量氢氧化钾(aq): Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| D.碳酸钾溶液中加入少量盐酸:CO32-+H+= HCO3- |
下列仪器加热时不需要垫石棉网的是
| A.蒸发皿 | B.蒸馏烧瓶 | C.锥形瓶 | D.烧杯 |