下图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是____________________________________________________。
制取乙炔的化学方程式是______________________________________________。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是______________________________,乙炔发生了________反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是__________,乙炔发生了________反应。
(4)为了安全,点燃乙炔前应________________________,乙炔燃烧时的实验现象________________________________________________________________________。
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: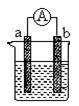
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用碱性溶液为电解液;则氢气应通入极(填a或b,下同),电子从极流出。a极发生电极反应式为:_____________________________。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)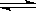 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度为,反应开始前容器中A、B的物质的量为;
(2) B的平均反应速率为;
(3)x=。
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: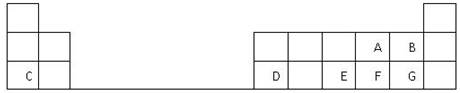
(1)画出A的原子结构示意图__________。
(2)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(3)D在元素周期表中的位置是第3周期第________族。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式________________________。
(6)A、C、D 的离子半径大小关系是___________________ (用离子符号表示)
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为
⑵在这些元素中,地壳中含量最多的金属元素是
⑶用电子式表示②与④形成化合物的过程 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是
⑸写出⑤与氢氧化钠溶液反应的化学方程式: 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
⑹某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子量为 ;HXR的化学式为 。
(4分)下面列出了几组物质,请将物质的合适组号填写在空格上。互为同位素的是,互为同分异构体的是,互为同系物的是,互为同素异形体的是。
①金刚石与“足球烯”C60;②D2O与T2O;③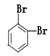 和
和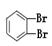
④CH4和CH3CH2CH3;⑤葡萄糖与果糖;⑥16O和18O