
某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素。实验过程如下:
如图所示,在大试管中加入5 mL 1 mol·L-1NaOH溶液和5 mL 1氯丁烷(1氯丁烷的沸点为77~78 ℃,密度为0.886 g·cm-3,易燃)。水浴加热该试管10 min以上,并控制加热温度在70~80 ℃。取2支小试管,各加入约1 mL由2%的AgNO3和3 mol·L-1硝酸按1∶1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1氯丁烷中含有氯元素。
请回答:
(1)请写出1氯丁烷水解的化学方程式:
________________________________________________________________________。
(2)试管上方的玻璃导管的作用为__________________。
(3)检验Cl-时,用硝酸酸化AgNO3溶液的目的是
________________________________________________________________________。
(4)该装置是有机化学实验中常用的一套装置,实验室中,可以使用上述装置制备的是________(填序号)。
| A.硝基苯 | B.乙烯 |
| C.乙酸乙酯 | D.溴苯 |
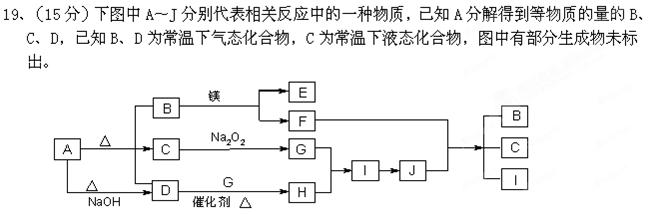
请填写以下空白:
(1)A的化学式B的电子式。
(2)写出下列反应的化学方程式:
D+G→ H 。 B+镁 → E + F
B+镁 → E + F  。
。
(3)写出A + NaOH →D的离子方程式。
(15分)A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为气体,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。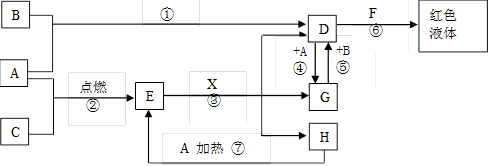
(1)写出:A的化学式,F的化学式。
(2)在反应①~⑦中,不属于氧化还原反应的是(填序号)。
(3)完成:E和X反应的离子方程式:;
(4)完成H和某种化合物快速制C的化学方程式
 ,每生成0.15molC电子转移mol。
,每生成0.15molC电子转移mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
。
(13分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z 在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)L的元素符号为;M在元素周期表中的位置为。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是。
(3)Y的最高价氧化物的电子式为。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一 种新型无机非金属材料,其化学式是。
种新型无机非金属材料,其化学式是。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_ _________ ______________________________________。
_________ ______________________________________。
( 2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式:。
若要确认其中有Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO 3-、SO42- 3-、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气 体又有沉淀
体又有沉淀 产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1)写出化学式:A___________ B___________ D_________
(2) E溶液呈酸性的原因是:(用离子方程式表示)
_______________________________
(3)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为mol