下列关于强、弱电解质的叙述中,错误的是
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同 |
| D.纯的强电解质在液态时,有的导电,有的不导电 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为()
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
下列分子或离子中,含有孤对电子的是()
| A.H2O | B.CH4 | C.SiH4 | D.NH4+ |
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是()
| A.该元素单质是导体 | B.该元素单质在一定条件下能与盐酸反应 |
| C.该元素的氧化物的水合物显碱性 | D.该元素的最高化合价呈+5价 |
x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知()
| A.x的原子半径大于y的原子半径 |
| B.x的电负性大于y的电负性 |
| C.x阴离子的半径小于y阳离子的半径 |
| D.x的第一电离能小于y 的第一电离能 |
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是()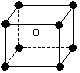
| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |