最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:
Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法不正确的是( )
| A.该电池Zn为负极,MnO2为正极 |
| B.该电池的正极反应为:MnO2+e-+H2O===MnOOH+OH- |
| C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D.电池工作时水分子和OH-都能通过薄层纸片 |
下列有关沉淀溶解平衡的说法中,正确的是( )
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
室温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-)。则下列关系中一定正确的是( )
| A.c(Na+)+c(H+)=c(HB-)+2c(B2-) | B.c(H+)·c(OH-)=10-14 |
| C.c(Na+)=c(B2-)+c(HB-) | D.溶液的pH=1 |
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC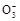 )+c(H+)>c(C )+c(H+)>c(C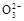 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S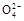 )>c(N )>c(N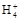 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC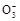 )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
下列叙述正确的是( )
A.浓度均为0.1 mol·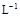 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)="0.2" mol· 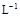 |
B.0.1 mol·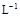 NaHCO3溶液中:c(Na+)=c(HC NaHCO3溶液中:c(Na+)=c(HC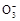 )+c(H2CO3)+2c(C )+c(H2CO3)+2c(C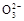 ) ) |
C.0.2 mol·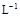 HCl溶液与等体积的0.1 mol· HCl溶液与等体积的0.1 mol·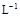 NaOH溶液混合后,溶液的pH=1 NaOH溶液混合后,溶液的pH=1 |
D.0.1 mol·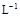 氨水中滴入0.1 mol· 氨水中滴入0.1 mol·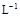 盐酸至溶液呈中性时,混合溶液中:c(N 盐酸至溶液呈中性时,混合溶液中:c(N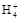 )=c(Cl-) )=c(Cl-) |
25 ℃时,浓度为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是( )
A.存在电离平衡HC  H++C H++C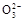 |
B.存在水解平衡HC +H2O +H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
D.加入NaOH固体,恢复到原温度,c(OH-)、c(C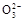 )均增大 )均增大 |