下列关于硅单质及其化合物的说法正确的是 ( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
| A.①② | B.②③ | C.①④ | D.③④ |
下列单质或化合物性质的描述正确的是
| A.Na2CO3的溶解性比NaHCO3小 |
| B.SiO2与酸、碱均能反应,属于两性氧化物 |
| C.FeCl3溶液制作铜质印刷线路板的离子反应为2Fe3++Cu=2Fe2++Cu2+ |
| D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
化学在生产和生活中有着广泛的应用。下列说法错误的是
| A.二氧化硫在食品加工中可用作食品增白剂 |
| B.航天飞机上的隔热陶瓷瓦属于复合材料 |
| C.用活性炭做净化剂除去冰箱中异味 |
| D.含H2SO4的废水用BaCl2处理后不可直接排放 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
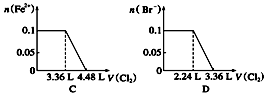
向含SO32-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是
A. Ce、 Ce、 Ce、 Ce、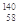 Ce、 Ce、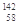 Ce它们互称为同素异形体 Ce它们互称为同素异形体 |
| B.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑ |
| C.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| D.工业上金属铈一般保存在敞口容器中 |