⑴已知氯气与水的反应Cl2+H2O HCl+HClO是一个可逆反应,即不能进行到底的反应,且反应生成的次氯酸(HClO)是一种酸性比碳酸还要弱的酸。写出盐酸的电离方程式:____________________。
HCl+HClO是一个可逆反应,即不能进行到底的反应,且反应生成的次氯酸(HClO)是一种酸性比碳酸还要弱的酸。写出盐酸的电离方程式:____________________。
(2)将少量铁粉投入到过量稀硝酸中发生反应的离子方程式是 ,在此反应中,硝酸体现了 性和 性。
(3)实验室中制取氨的化学方程式为 用 法收集。
如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
 |
请回答下列问题:
(1)写出F的化学式:;(2)写出G的电子式:;
(3)反应①的化学方程式为;
人们将反应①所涉及的化学工业称为;
(4)反应⑤的离子方程式为;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒
② 。
工业上制备H2的一种重要方法是:CO(g)+H2O(g) CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
 时间/min 时间/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c4 |
| 4 |
c1 |
c2 |
c3 |
c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
| A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中H2(g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的消耗速率 |
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol·L=1,CO(g)的转化率为 。
阿司匹林能迅速解热、镇痛。长效缓释阿司匹林可在体内逐步水解而疗效更佳。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。

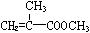 回答下列问题:
回答下列问题: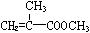 (1)上述合成C的路线曾用作有机玻璃单体()合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得,其化学方程式为:。
(1)上述合成C的路线曾用作有机玻璃单体()合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得,其化学方程式为:。
如此改进的优点为:。
(2)阿司匹林的结构简式为,下列物质与阿司匹林互为同分异构体的有(填字母编号)。
 |
(3)根据题示信息,用苯酚为主要原料合成,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH浓硫酸170℃CH2=CH2高温、高压催化剂 CH2-CH2
CH2-CH2
请仔细观察两种电池的构造示意图,回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析
其原因是
(3)某工厂回收废旧锌锰电池,其工艺流程如下:
已知:生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
8.0 |
9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2。
②第一次加入H2O2后,调节pH=8.0。目的
是。
③试列举滤液4的应用实
例。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
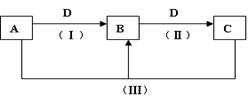 |
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为。
(2)A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ)的化学方程式为。
(3)D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以
是。
(4)D为酸或酸性气体,则A、B、C、D可以是(请按顺序写出合理任意一组物质的化学式即可)。