工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除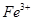 外还可能含有
外还可能含有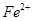 。若要确认其中的
。若要确认其中的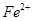 ,应选用 选填序号)。
,应选用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性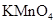 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: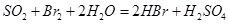 ,然后加入足量
,然后加入足量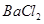 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中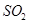 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中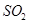 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。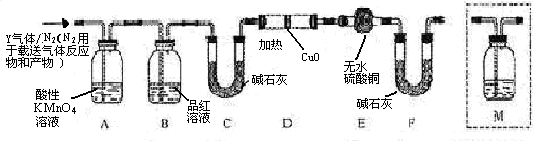
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是 。
,预计实验现象应是 。
(18分)(1)元素周期表16号元素是_____(写元素符号),它的原子结构示意图为_______,故它在周期表的位置是第______周期第______族,它对应形成的阴离子结构示意图为_________________。该元素的最高正化合价为_____,最低负化合价为_____。
(2)元素周期表中碱金属元素半径最小的是________,金属性最强的是________。(写元素符号)
(13分)A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应.B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100 mL2 mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第周期族,它的最高价氧化物的化学式为。
(2)写出元素的名称: A、B、D;
(3)A与D形成淡黄色的化合物的化学式为,
判断该化合物在空气中是否变质的简单方法是__。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为。
(11分)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等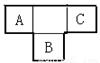
(1)写出元素的符号: A、B、C;
(2)B元素位于元素周期表中第 周期,第族。
(3)C的原子结构示意图为 ,用电子式表示C的单质与H2反应的过程。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有 。
(12分)(1)下列变化(填序号)①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。
未发生化学键破坏的是;仅发生离子键破坏的是;
仅发生共价键破坏的是;既发生离子键又发生共价键破坏的是;
(2)用电子式写出MgCl2、HCl的形成过程
①MgCl2的形成过程:;
②HCl的形成过程:;
(8分)由以下一些微粒:136C、3919K、4020Ca、126C、147N、4018Ar
其中:(1)互为同位素的是________和________;
(2)质量数相等,但不能互称同位素的是_________和__________;
(3)中子数相等,但质子数不相等的是和、和。