决定金属性强弱的是
| A.1个金属原子失去电子的多少 | B.1 mol金属与酸反应放出氢气的多少 |
| C.1 mol金属失去电子的多少 | D.金属原子失去电子的难易程度 |
设NA为阿伏加德罗常数,下列叙述中正确的是
| A.12.4g白磷晶体中含有的P-P键数是0.4NA |
| B.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA |
| C.2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA |
| D.1mol甲醇中含有C—H键的数目为4NA |
根据电子排布的特点,Ar在周期表属于
| A.s区 | B.p区 | C.d 区 | D.ds区 |
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是
| A.工业上利用热还原法冶炼金属Fe、Cr、Mn |
| B.Fe位于元素周期表的第四周期、第ⅧB族 |
C. TiO2、 TiO2、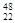 TiO2、 TiO2、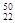 TiO2互为同位素 TiO2互为同位素 |
D.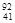 Nb3+原子核内有51个中子,核外有44个电子 Nb3+原子核内有51个中子,核外有44个电子 |
2010年诺贝尔物理奖授予发现石墨烯的开创性研究者,金刚石、石墨、C60和石墨烯的结构示意图分别如下图所示,下列说法不正确的是
| A.金刚石和石墨烯中碳原子的杂化方式不同 |
| B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体 |
| C.这四种物质完全燃烧后的产物都是CO2 |
| D.石墨与C60的晶体类型相同 |
如图是一种染料敏化太阳能电池的示意图。电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: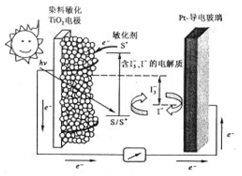
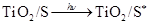 (激发态)
(激发态)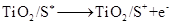
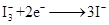
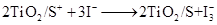
下列关于该电池叙述错误的是
| A.电池工作时,是将太阳能转化为电能 |
| B.电池中镀铂导电玻璃为正极 |
| C.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| D.电池的电解质溶液中I-和I3-的浓度不会减少 |