三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 |
A |
B |
C |
| 结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;(1分)
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键 ;A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,
(4) 科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下: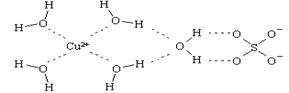
则胆矾晶体中含有
A.配位键 B.离子键 C.极性共价键 D. 金属键 E.氢键 F.非极性共价键
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。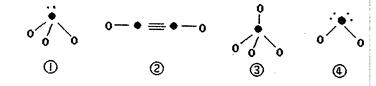
在以上分子中,中心原子采用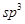 杂化形成化学键是 (填写序号)。
杂化形成化学键是 (填写序号)。
(本题8分)汽车尾气是造成雾霾天气的重要原因之一。已知:
①N2(g)+O2(g) 2NO(g) ΔH1②2NO(g)+O2(g)
2NO(g) ΔH1②2NO(g)+O2(g) 2NO2(g)ΔH2
2NO2(g)ΔH2
③CO2(g) CO(g)+1/2O2(g)ΔH3④2CO(g)+2NO(g)
CO(g)+1/2O2(g)ΔH3④2CO(g)+2NO(g) N2(g)+2CO2(g)ΔH4
N2(g)+2CO2(g)ΔH4
请完成以下问题:
(1)请根据反应①②③,确定反应④中ΔH4=。
(2)根据图1,反应④的热化学方程式为:。
该反应在(填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(3)图2表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为:, X、Y、Z三点,CO的转化率由大到小的顺序是。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K=(算出数值)。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01 mol/L、a mol/L、0.01 mol/L、0.04 mol/L,要使反应向正方向进行,a的取值范围为。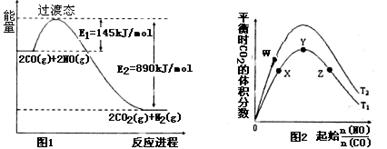
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol-1
2SO3(g) ΔH=−196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH =−113.0 kJ·mol-1
2NO2(g)ΔH =−113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH =kJ·mol-1。
SO3(g)+NO(g)的ΔH =kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。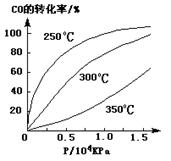
(本题8分)对于反应xA(g)+yB(g)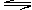 pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
pC(g)+qD(g)压强与温度对C的质量分数的影响如图: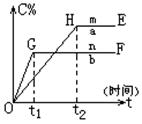
(1)若m、n表示不同温度,则mn,正反应为反应(填“放热”、“吸热”);
(2)若m、n表示不同压强,则mn,(x+y)(p+q)(填<、>、=);
(3)b曲线的OG段比a曲线的OH段陡的原是:;
(4)a曲线的HE段高于b曲线的GF段的原是:。
(8分)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: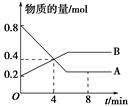
(1)该反应的化学方程式为____________________________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”), 8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:。
(2)已知化学键的键能为:
| 化学键 |
H—H |
N—H |
 |
| 键能/( kJ·mol-1) |
436 |
391 |
945 |
又知反应N2(g)+3H2(g) 2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为。
2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为。
(3)已知:C(石墨,s)+O2(g) CO2(g) ΔH="-393" kJ·mol-1
CO2(g) ΔH="-393" kJ·mol-1
2H2(g)+O2(g) 2H2O(l)ΔH=-571.6 kJ·mol-1
2H2O(l)ΔH=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
根据盖斯定律,计算298 K时C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为。