根据下列结构示意图,判断下列说法中不正确的是
| A.在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
| B.在CaF2晶体中,每个晶胞平均占有4个Ca2+ |
| C.在金刚石晶体中,碳原子与碳碳键数目比为1:2 |
| D.该气态团簇分子的分子式为EF或FE |
一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g) 2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
| A.反应前2min的平均速率v(SO2)=0.1amol/(L.min) |
| B.当混合气体的物质的量不再改变时,反应达到平衡状态 |
| C.平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动 |
| D.平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大 |
汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3 H++HCO3-……① HCO3-
H++HCO3-……① HCO3- H++CO32-……②
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
| A.加热、平衡①、②可能都向左移动 |
| B.加入澄清石灰水,平衡①、②均向右移动 |
| C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动 |
| D.通入过量CO2或滴加氯水,溶液pH均减小 |
下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是
| 选项 |
条件 |
离子组 |
离子共存判断及反应的离子方程式 |
| A |
滴加氨水 |
Na+、Al3+、Cl-、NO3- |
不能共存,Al3++3OH-=Al(OH)3↓ |
| B |
pH=1的溶液 |
Fe2+、Al3+、SO42-、MnO4- |
不能共存, 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
| C |
由水电离出的H+浓度为1×10-12mol/L |
NH4+、Na+、NO3-、Cl- |
一定共存,NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| D |
通入少量SO2气体 |
K+、Na+、ClO-、SO42- |
不能共存, 2ClO-+SO2+H2O=2HClO+SO32- |
短周期元素X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是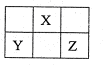
| A.原子半径的大小为:Z>Y>X |
| B.若X的一种单质为原子晶体,则含Y元素的盐溶液一定呈酸性 |
| C.若Y可作半导体材料,则X、Z的单质均为分子晶体 |
| D.若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.11gT2O含有的中子数为6NA |
| B.1molNa2O2与CO2完全反应转移的电子数为2NA |
| C.常温下,0.2L0.5mol/LNH4NO3溶液的氮原子数小于0.2NA |
| D.标准状况下,2.24LH2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |