C(石墨)=C(金刚石),△H=+ 1.895kJ/mol ,相同条件下,下列说法正确的是( )
| A.石墨比金刚石稳定 |
| B.金刚石比石墨稳定 |
| C.相同物质的量的石墨比金刚石的总能量高 |
| D.两者互为同位素 |
反应4NH3(g)+5O2(g)====4NO(g)+6H2O(g)在2 L密闭容器中进行1分钟后,NH3减少了0.12 mol,则平均每秒钟浓度变化正确的是
| A.NO:0.001 mol·L-1 | B.H2O:0.002 mol·L-1 |
| C.NH3:0.002 mol·L-1 | D.O2:0.0025 mol·L-1 |
下列说法中正确的是
| A.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| B.自发反应在恰当条件下才能实现 |
| C.自发反应在任何条件下都能实现 |
| D.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
以NA代表阿伏加德罗常数,则关于热化学方程式
C2H2( g ) +5/2O2(g) 2CO2( g )+H2O( l ) ΔH=-1 300 kJ·mol-1的说法中,正确的是
2CO2( g )+H2O( l ) ΔH=-1 300 kJ·mol-1的说法中,正确的是
| A.当10NA个电子转移时,该反应吸收1 300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1 300 kJ的能量 |
| C.当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量 |
| D.当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量 |
一定条件下,充分燃烧一定量的丁烷放出热量Q kJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5 mol·L-1 KOH溶液100 mL,恰好生成正盐,则此条件下反应:C4H10(g)+13/2O2(g)====4CO2(g)+5H2O(l)的ΔH为
| A.+8Q kJ·mol-1 | B.+16Q kJ·mol-1 |
| C.-8Q kJ·mol-1 | D.-16Q kJ·mol-1 |
根据右图,下列热化学方程式书写正确的是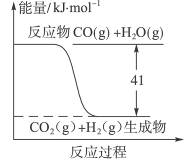
| A.CO+H2O====CO2+H2 ΔH=-41 kJ·mol-1 |
| B.CO(g)+H2O(g)====CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| C.CO2(g)+H2(g)====CO(g)+H2O(g) ΔH=+ 41 kJ·mol-1 |
| D.CO2(g)+H2(g)====CO(g)+H2O(g) ΔH=-41 kJ·mol-1 |