下列叙述中,正确的是( )
A.将0.l mol· 醋酸溶液加水稀释,溶液中所有离子的浓度都减小 醋酸溶液加水稀释,溶液中所有离子的浓度都减小 |
B.0.1 mol/L的一元弱酸HA加水稀释过程中,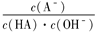 不变 不变 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.中和10 mL 0.1mol·L-1 醋酸与中和100 mL 0.01mol·L-1 的醋酸所需同种碱液的量不同 |
升高温度,下列数据不一定增大的是( )
| A.化学反应速率v | B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,该溶液可能是()
| A.pH等于5的醋酸溶液 | B.一定浓度的NaOH溶液 |
| C.一定浓度的NaHSO4溶液 | D.一定浓度的NH4Cl溶液 |
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
有关工业合成氨的反应:N2+ 3H2 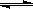 2 NH3的说法不正确的是( )
2 NH3的说法不正确的是( )
| A.该反应为可逆反应,故在一定条件下N2和H2不可能全部转化为NH3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入1mol N2和3mol H2,则从反应开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产NH3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
氢氧燃料电池是一种新能源。如图为氢氧燃料电池示意图。下列说法不正确的是( )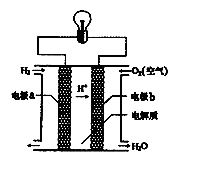
| A.a极是正极,b极是负极 |
| B.该装置能将化学能转化为电能 |
| C.电子由a极通过导线流向b极 |
| D.供电时总反应为2H2+O2=2H2O |