已知电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙。请你根据已学知识,按下图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是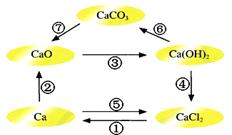
| A.CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物 |
| B.电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应 |
| C.往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液都能实现反应⑥的转化 |
| D.工业上可通过反应④往石灰乳中通入氯气生产漂白粉,所得漂白粉的主要成分为CaCl2 |
下列反应不能用离子方程式CO +2H+=CO2↑+H2O表示的是
+2H+=CO2↑+H2O表示的是
| A.Na2CO3+2HCl=2NaCl+CO2↑+H2O | B.CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| C.K2CO3+H2SO4=K2SO4+CO2↑+H2O | D.K2CO3+2HNO3=2KNO3+CO2↑+H2O |
下列关于胶体的的叙述正确的是
| A.制备Fe(OH)3胶体通常是将Fe(OH)3固体溶于沸水 |
| B.可利用过滤的方法区分溶液和胶体 |
| C.直径介于1nm~100nm之间的微粒称为胶体 |
| D.胶体介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系 |
小明在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是
| A.分解反应 | B.复分解反应 |
| C.化合反应 | D.置换反应 |
电解质是
| A.导电性很强的物质 | B.在水溶液里或熔融状态下能导电的化合物 |
| C.可溶性盐类 | D.在水溶液里和熔融状态下能导电的化合物 |
下列物质中,摩尔质量最大的是
| A.10mlH2O | B.0.8molH2SO4 | C.54gAl | D.1gCaCO3 |