为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会________(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)_________________________________________________________________________。
(3)方案三中的“冷却”应如何操作:
____________________________________________________________;
理由是_________________________________________________________。
(4)方案四中计算碳酸钙纯度的公式为______________;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将________(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是________。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案________:_____________________________________________________。
方案________:____________________________________________________。
从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质有__________
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质有_________(3)以石墨为电极进行电解,使电解质和水的质量都减少,可采用的电解质有_______________
(5分) (1)常温下,pH=11的NaOH溶液稀释1000倍后溶液的pH为_______________,稀释105倍后溶液的pH为_______________
(2)在pH为11的Ba(OH)2溶液中,溶质的物质的量浓度为_______________mol/L,水电离出的C(OH-)为_______________mol/L
(3)25℃时,将pH=10和pH=12的NaOH溶液等体积混合,混合后溶液的pH=_______________。
(1)写出下列物质的电离方程式:
①H2S:______________________________
②NaHCO3溶于水:______________________________
③NaHSO4溶于水:______________________________
(2)下出下列盐的水解方程式(离子方程式):
①NH4Cl: ______________________________
②明矾净水原理(只写相应离子的水解方程式):______________________________
③泡沫灭火器(硫酸铝和碳酸氢钠)的灭火原理:______________________________
(3)写出难溶电解质的溶度积表达式。Mg(OH)2:______________________________
(4)下出下列反应方程式:
①钢铁发生吸氧腐蚀的正极反应式:______________________________
②氢氧燃料电池,H2SO4做电解质溶液,正极反应式:______________________________
③电解饱和食盐水的总反应方程式:______________________________
下图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质。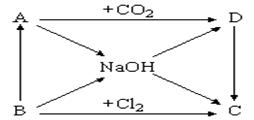
(1)写出C的化学式:________________ 。
(2)写出实现下列变化的化学方程式:
① B → NaOH:________________________________________,
② A → D:________________________________________ ,
(3)浓NaOH溶液能跟地壳中含量最多的金属元素的单质反应,写出该反应的离子方程式:____________________ 。
(1)在密闭容器里,通入x mol SO2和y mol O2,发生化学反应:2SO2 (g) + O2 (g) 2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
①降低温度____________________ ;
②当容器容积不变,充入更多的O2 ____________________ ;
③当容器容积不变,通入氖气____________________。
(2)来自石油的基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
④可以用来鉴别苯蒸气和乙烯的试剂是____________________(填序号)。
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液
⑤苯分子具有平面正六边形结构,所有原子共一个平面,则苯分子中在一条直线上的原子最多有____________________ 个。
⑥在一定条件下,乙烯能与水发生加成反应生成有机物A,写出A与Na反应的化学方程式________________________________________。