已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,试分析该硝酸盐分解时金属化合价的变化情况是( )
| A.升高 | B.降低 | C.不变 | D.不能确定 |
下列溶液中,一定能大量共存的离子组是
| A.能使氢氧化铝迅速溶解的溶液: Na+、Fe2+、NO3— 、SO42— |
| B.能使酚酞试液变红的溶液: Na+、NH4+、 CO32—、SO42— |
| C.含有大量SO42—的透明溶液: K+ 、Cu2+ 、Cl—、NO3— |
| D.含有大量ClO—的溶液: H+、 Mg2+、I—、SO42— |
几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列说法正确的是
A.L、Q形成的简单离子核外电子数相等
B.L、R的单质与盐酸反应速率为R>L
C.Q、T两元素的氢化物的稳定性为HnT<HnQ
D.M与T形成的化合物能与NaOH溶液反应
关于实验室制备乙酸乙酯的说法中正确的是
| A.实验前,先向试管中加入2mL浓硫酸,然后再加入3mL乙醇和2mL乙酸 |
| B.收集乙酸乙酯的试管中应加入的试剂为饱和碳酸钠溶液 |
| C.实验中需加入碎瓷片作催化剂 |
| D.导管末端要插入液面以下 |
下列物质中互为同分异构体的是
A. |
B.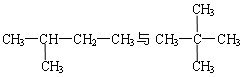 |
| C.CH4和CH3CH3 |
| D.淀粉和纤维素 |
下列化学用语表示正确的是
| A.N2的电子式:N N |
| B.乙酸的分子式:CH3COOH |
C.硫离子结构示意图: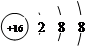 |
| D.乙烷的结构式:CH3CH3 |