已知:① S(单斜,s)+O2(g) = SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) = SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) = S(正交,s) △H3
下列说法正确的是( )
| A.S(单斜)和S(正交)互为同分异构体 |
| B.△H3= + 0.33 kJ·mol-1 ,单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s) = S(正交,s) △H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s) = S(正交,s) △H3>0,单斜硫比正交硫稳定 |
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。下列说法不正确的是 ( )。
| A.“联合制碱法”和“氨碱法”的化学反应原理中都有下列化学反应 NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl 2NaHCO3  Na2CO3+H2O↑+CO2↑ Na2CO3+H2O↑+CO2↑ |
| B.“联合制碱法”生产中有氨的循环利用工艺 |
| C.“氨碱法”生产中有氨的循环利用工艺 |
| D.“联合制碱法”和“氨碱法”都有一定的局限性 |
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的方法中正确的是 ( )。
| A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打 |
| C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打 |
| D.先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
(1)1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4 Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3 Na2CO3+CaS
Na2CO3+CaS
(2)下列说法正确的是 ( )。
| A.②③两步都是氧化还原反应 |
| B.只有第②步是氧化还原反应 |
| C.该方法对生产设备基本没有腐蚀 |
| D.该方法对环境污染较小 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。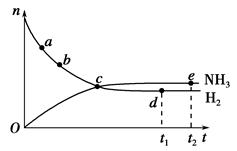
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列说法正确的是( )。
2NH3(g) ΔH<0,下列说法正确的是( )。
| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |