碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+ O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
下图是某些常见物质之间的转化关系。A、I是金属单质,F、G是非金属单质。已知B的相对分子质量在75~80之间,E是A的氧化物、其相对分子质量为232。请按要求填写下列空白: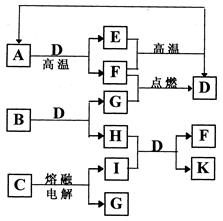
(1)A、B、C代表的物质分别是,,(填化学式)。
(2)写出B物质的电子式。
(3)K的水溶液呈碱性,用离子方程式说明其呈碱性的原因。
(4)写出I→K的离子方程式:。
(5)当有0.15molA完全反应时,反应中转移电子的物质的量为。
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
N2+2CO2。
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为:
K=。
(2)已知:CO(g)+ O2(g)=2CO2(g)△H=一283 kJ/mol
O2(g)=2CO2(g)△H=一283 kJ/mol
N2(g)+O2(g)="2" NO(g)△H="+180" kJ/mol
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=kJ/mol。
N2(g)+2CO2(g)△H=kJ/mol。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳 出行
出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成NaCO3的物质的量为mol。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为。
(2)⑥和⑦的最高价含氧酸的酸性强弱为>。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②写出检验A溶液中溶质的阴离子的方法。
③常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为mol。
④若上图中各步反应均为完全转化,则混合物x中含有的物质有。
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛 的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
请回答下列问题:
(1)关于麻黄碱下列说法正确的是(填字母)。
a.麻黄碱的分子式为C15H15NO
b.具有止咳平喘作用,是从中药麻黄中提取的生物碱
c.属于国际奥委会严格禁止的兴奋剂
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量分数之比为42:3:8,
则A的含氧官能团名称是;检验该官能团的方法是
(3)反应①~⑤中属于取代反应的是(填序号)。
(4)写出D—B的化学方程式。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式。
(6)写出符合下列条件的同分异构体的结构简式。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| 溶解性 |
沸点 |
|
| A |
微溶于水 |
179.0℃ |
| E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是
。
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++=====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含 Hg2+3×10-17mo1,是否达到了排放标准(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某 研究性学习小组测定某水样的化学需氧量(COD),过程如下:
研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr20,溶液的仪器是。
②Ⅱ中,碎瓷片的作用是。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+==2Cr3++6Fe3+7H2O
由此可知,该水样的化学需氧量COD=(用含c、V1、V2的表达式表示)。