0.02 mol某金属单质与足量的盐酸反应,放出0.672 LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是
| A.第三周期第ⅡA族 | B.第三周期第ⅢA族 |
| C.第二周期第ⅢA族 | D.第四周期第ⅡA族 |
氢镍电池的总反应式是H2 + 2NiO(OH)  2Ni(OH)2 。根据此反应判断,下列叙述中不正确的是()
2Ni(OH)2 。根据此反应判断,下列叙述中不正确的是()
| A.放电时,电池负极周围溶液的pH不断增大 | B.电池充电时,镍元素在阳极被氧化 |
| C.电池放电时,H2是负极 | D.电池充电时,H2在阴极生成 |
将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )
①通入CH4的电极为正极;②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;⑥放电时溶液中的阴离子向负极移动。
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
有关右图装置的叙述正确的是 ( )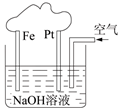
| A.这是一个电解池装置 |
| B.这是电解NaOH溶液的装置 |
| C.该装置中Fe为阴极,电极反应为:Fe-2e-+ 2OH-=Fe(OH)2 |
| D.该装置中Pt为正极,电极反应为:O2 +2H2O+4e-=4OH- |
银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;
Ag2O+H2O+2e- = 2Ag+2OH-;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是()
| A.锌为正极,Ag2O为负极 | B.锌为负极,Ag2O为正极 |
| C.原电池工作时,正极区PH减小 | D.原电池工作时,负极区PH增大 |
强酸与强碱的稀溶液发生中和反应的热效应为:
H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
| A.△H1>△H2>△H3 | B.△H1<△H2<△H3 |
| C.△H1<△H2=△H3 | D.△H1=△H2<△H3 |