现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。
请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有 (填代号)。
(2)经计算,需浓硫酸的体积为 ;
现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是 。(填代号)
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤烧杯和 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度 cm处,改用 滴加蒸馏水到 与刻度线相切。塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有 (填代号)。
①转移前,容量瓶中含有少量蒸馏水
②定容时,加蒸馏水超过标线,又用胶头滴管吸出
③定容时,俯视刻度线
④定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(本题共12分)硝基苯是制造染料的重要原料。某同学在实验室里用下图装置制取硝基苯,主要步骤如下:
①在大试管里将2mL浓硫酸和1.5mL浓硝酸混合,摇匀,冷却到50~60℃以下。然后逐滴加入1mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60℃的水浴中加热10分钟。
完成下列填空:
33、指出右图中的错误、。
34、向混合酸中加入苯时,“逐滴加入”、“边滴边振荡试管”的目的是。
35、反应一段时间后,混合液明显分为两层,上层呈色,其中主要物质是(填写物质名称)。把反应后的混和液倒入盛有冷水的烧杯里,搅拌,可以看到。(选填编号)
a.水面上是含有杂质的硝基苯
b.水底有浅黄色、苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
36、为了获得纯硝基苯,实验步骤为:①水洗、分离;②将粗硝基苯转移到盛有_____________的烧杯中洗涤、用______________(填写仪器名称)进行分离;③;④干燥;⑤。
37、实验装置经改进后,该同学按照上述实验步骤重新进行了多次实验,充分反应后有两种情况出现,请帮助他作出分析:
(1)产率低于理论值,原因是;
(2)产率高于理论值,原因是。
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验一】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):
36.装置D的作用是;如果没有B装置,C中发生的副反应有。
37.就算在装置气密性良好的情况下进行实验,该小组发现制得的NaNO2的纯度也不高,可能的原因是;设计一种提高NaNO2纯度的改进措施。
【实验二】测定NaNO2样品(含NaNO3杂质)的纯度
先查阅资料知:①5NO2-+ 2MnO4-+ 6H+ → 5NO3-+ 3Mn2+ + 3H2O;
②MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
然后,设计如下方案测定样品的纯度。
38.取样品2.3g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500mol/L的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为_________。
39.通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是(填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
铵明矾【NH4Al(SO4)2·12H2O】是常见的食品添加剂,用于焙烤食品,可通过硫酸铝溶液和硫酸铵溶液反应制备。用芒硝(Na2SO4·10H2O)制备纯碱和铵明矾的生产工艺流程图如图1:
完成下列填空:
31.铵明矾溶液呈性,它可用于净水,原因是;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是。
32.写出过程Ⅰ的化学反应方程式。
33.若省略过程Ⅱ,直接将硫酸铝溶液加入滤液A中,铵明矾的产率会明显降低,原因是。
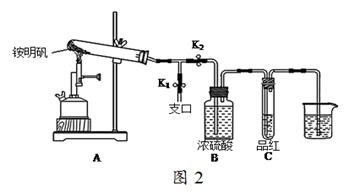
34.已知铵明矾的溶解度随温度升高明显增大。加入硫酸铝后,经过程III的系列实验得到铵明矾,该系列的操作是加热浓缩、、过滤洗涤、干燥。
35.某同学用图2图示的装置探究铵明矾高温分解后气体的组成成份。
(1)夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是(任填一种物质的化学式);另分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式。
(2)该同学通过实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=。
(18分)用硼镁矿(主要成分为Mg2B2O5·H2O,含少量A12O3和Fe3O4)制取粗硼的工艺流程为: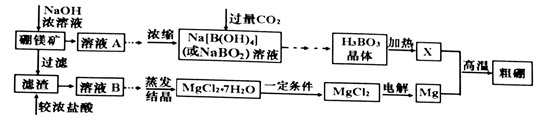
已知:①硼与铝的性质相似,也能与氢氧化钠溶液反应。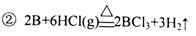
③BCl3的熔点为-107.3℃,沸点为l2.5℃,在潮湿空气中易形成白雾。
I.回答下列问题:
(1)证明溶液B中含有铁元素的方法是________________________________________
(2)Mg与X反应制取粗硼的化学方程式________________________________________
(3)上图中制取MgCl2的“一定条件”是指______________________________________
II.某同学设计如图所示装置制备三氯化硼。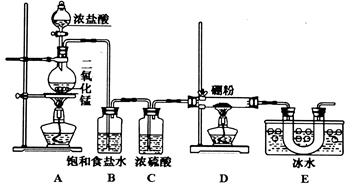
回答下列问题:
(4)E装置的作用是___________________________。
(5)如果去掉B装置,可能的后果是____________________。
(6)E装置后面还应连接的一个装置是________。
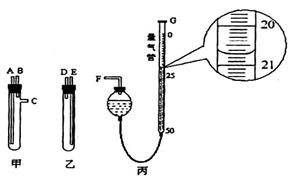
某化学小组在实验室模拟高炉炼铁,其部分装置如下: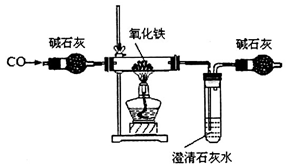
请完成下列填空:
(1)利用甲酸与浓硫酸反应HCOOH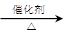 CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
(2)判断上述装置中CO与氧化铁发生反应的现象为____________;该装置存在的缺陷是__________。
(3)已知受热不均时,可发生副反应CO+Fe2O3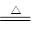 CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
①样品和稀硫酸应分别置于________、_________仪器中(填“甲”或“乙”),甲、乙试管中接口的连接方式为:A连接_______,B连接_______,C连接F(填各接口的编号)。
②量气管可以用化学实验室中一种常用仪器来改装,该仪器的名称是___________。当气体不再产生且恢复至室温时,如丙图所示量气管读数______________mL。若量气之前的其他操作均正确,根据该读数并将产生的气体体积换算为标准状况后,所计算样品中铁的质量分数将__________(填“偏大”、“偏小”或“无影响”),原因是______(若无影响该空不必作答)。