可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-==4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-==Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关0.1mol·L-1醋酸钡溶液中粒子浓度的比较中错误的是()
| A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)=c(OH-)-c(CH3COOH) |
| C.2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
| D.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-) |
温度和浓度均相同的下列溶液:①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4Cl、⑤NaClO⑥CH3COONa,它们的pH值由小到大的排列顺序是()
| A.③①②④⑤⑥ | B.⑤⑥②④①③ | C.③①④②⑥⑤ | D.③①⑥④②⑤ |
25℃时,水的电离达到平衡:H2O H++OH- △H>0,下列叙述正确的是()
H++OH- △H>0,下列叙述正确的是()
| A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| B.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| C.向水中加入固体硫酸铜,平衡逆向移动,c(OH-)减小 |
| D.将水加热,KW增大,pH不变 |
2 molA与2 molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)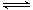 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是()
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是()
A.z=2
B.2s后,容器内的压强是初始的7/8倍
C.2s时C的体积分数为2/7
D.2s后,B的浓度为0.5mol/L
下列事实能用勒夏特列原理解释的是()
A.FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B.工业合成氨中,将氨气液化分离
C.A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D.对于反应2NO2(g) N2O4(g)△H<0,升高温度可使体系颜色变深
N2O4(g)△H<0,升高温度可使体系颜色变深