下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。 若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
实验室中的药品常按物质的性质、类别等有规律的摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时 ,某同学取用BaCl2溶液后,应把它放回的位置是
,某同学取用BaCl2溶液后,应把它放回的位置是 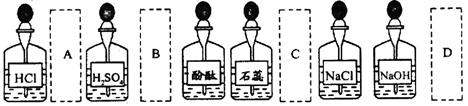
设NA表示阿伏加德罗常数值,下列叙述正确的是
| A.NA个氧气分子和NA个氢气分子的质量比为16∶1 |
| B.标准状况下,22.4LH2O含有的分子数为NA |
| C.11.2L氯气中含有的原子数为NA个 |
| D.2L 1mol/L Na2SO4溶液中Na+离子数为2NA个 |
在某无色透明的酸性溶液中,能共存的离子组是
| A.Mg2+、SO42- 、K+、Cl- | B. 、 、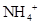 、 、 、 、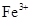 |
C. 、CO32-、 、CO32-、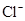 、 、 |
D.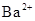 、 、 、 、 、 、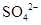 |
对于下列事实的解释错误的是( )
| A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| D.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
下列物质中,能够导电的电解质是
| A.Cu丝 | B.熔融的MgCl2 | C.NaCl溶液 | D.蔗糖 |